昔日“天价药”降价后替代之战?重庆药友诺西那生钠冲击首仿,渤健压力山大?-九游会官方网站登录
在经历了大幅降价进入医保后,渤健的诺西那生钠又将迎来新的挑战。
日前,cde官方网站公示,重庆药友制药提交的诺西那生钠注射液上市申请获得受理。据悉,这是国内首个按照4类仿制药申报的诺西那生钠注射液,有望冲击该品种的首仿。

渤健原研的诺西那生钠注射液于2019年4月在国内获批上市,是一款治疗罕见病脊髓性肌萎缩症(sma)的“孤儿药”,曾经因为销售价高达70万/针,受到极大的市场和舆论关注。2021年,国家医保局开展的“灵魂砍价”谈判,将诺西那生钠的“天价”降至3.3万的“地板价”,成功进入国家医保目录。
在经过医保谈判降价之后,国内sma患者对诺西那生钠注射液的可及性和可支付性大大提高。如今,围绕罕见病sma领域,随着国产仿制药报产,渤健研发迎新进展,这一细分治疗赛道的未来市场竞争将愈发激烈,也将进一步满足患者的临床需求。
诺西那生钠首仿将至渤健如何面对新挑战?
脊髓性肌萎缩症(sma)为常染色体隐性遗传疾病,是由于运动神经元存活基因1(smn1)突变导致smn蛋白功能缺陷所致的遗传性神经肌肉病。sma以脊髓前角运动神经元退化变性和丢失导致的肌无力和肌萎缩为主要临床特征。
渤健开发的诺西那生钠注射液是全球首个sma治疗药物,也是国内首款获批上市的反义寡核苷酸(aso)类药物。据悉,诺西那生钠注射液采用ionis的专有反义技术开发,旨在用于治疗因smn1基因(位于染色体5q)突变或缺失,造成smn蛋白缺乏,进而引起的sma。
与一般药物分子不同,aso是精准设计的具有靶向作用的特定核苷酸序列,可以通过调节mrna功能改变蛋白质的表达。理论上,超过15聚体的aso在人类mrna中具有唯一的结合位点,这样能够减少潜在的脱靶效应。诺西那生钠是18聚体的aso,作用位点精准,特异性高,从而可以减少由于脱靶效应产生的不良事件。
米内网数据显示,渤健的诺西那生钠全球销售额在2019-2020年均超过20亿美元,2023年达到17亿美元。国内方面,在公立医疗机构终端,诺西那生钠的销售额在2022年涨至接近6亿元,2023年略有下降,销售额近5亿元。
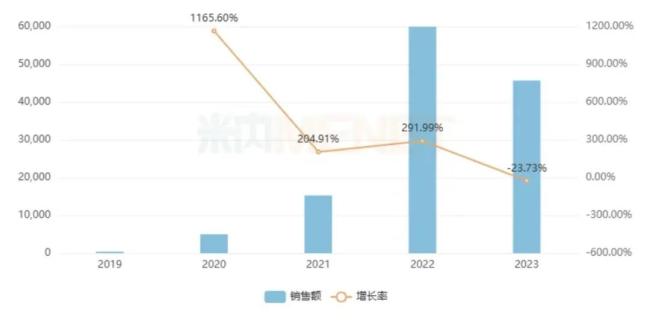
诺西那生钠注射液在国内市场的销售情况(单位:万元)
为提高罕见病诊疗水平,维护罕见病患者健康权益,2018年5月,sma被纳入中国《第一批罕见病目录》;同年,诺西那生钠作为全球首个sma的精准靶向治疗药物,进入《第一批临床急需境外新药名单》。尽管渤健的诺西那生钠注射液次年便在国内获批上市,但其“天价”却让患者望而却步。
在2021年的医保谈判中,诺西那生钠经历了“灵魂砍价”,最终进入医保药品目录,得以惠及更多sma患者。这对行业而言意义重大,这是医保部门和外资创新药企之间共同努力的重大成果,一定程度上反映出监管部门对高价值创新药的态度。为真正创新的、临床急需的药品买单,是医保部门对创新技术的认可与支持。
除了切实提升患者的用药可支付性,监管部门也在不断为丰富临床用药选择而努力。2022年10月,国家药监局发布关于《仿制药参比制剂目录(第六十一批)》的通告(2022年第52号),将诺西那生钠注射液列入了参比制剂目录,为制药企业提供了高质量仿制指引。
值得一提的是,美国fda在同年还颁布了诺西那生钠注射液的等效性研究指南,其中要求除了q1、q2和rld一致外,api还需要和rld的圆二色谱(cd)、差示扫描量热法曲线(dsc)、体积排除色谱(sec)、沉降速率分析超离心法曲线(sv-auc)等一致,进而可以免除人体的be试验。
可以看到,近年来,以sma为代表的一些罕见病诊疗进入了发展快车道。业内人士表示,可以推断药友制药是在上述多项政策颁布后,进行诺西那生钠仿制药的研发立项。作为首家申报诺西那生钠注射液仿制上市的国内药企,重庆药友制药有望成为首个诺西那生钠的首仿企业,将有很大的时间优势与渤健竞争国内sma治疗药物的市场份额。
新药研发进展不断sma治疗药物市场格局迎变
目前,全球仅有三款治疗sma的药物获批上市,即渤健的诺西那生钠、诺华的zolgensma和罗氏的evrysdi(risdiplam,利司扑兰)。其中,渤健和罗氏的相关药物已在国内获批上市,诺华的aav基因治疗药物zolgensma在中国递交的临床试验申请已获得临床试验默示许可。
尽管sma治疗已取得重大进展,但仍有大量未满足的需求,渤健也在持续探索进一步提升诺西那生钠疗效的可能性。9月9日,渤健公布了2/3期devote研究关键队列(b部分)的积极主要数据。这项研究评估了高剂量诺西那生钠治疗方案对已表现出sma症状的初治婴儿患者的安全性和疗效。
 相较已获批的诺西那生钠治疗方案,该在研高剂量治疗方案的初期给药速度更快(两次50毫克,间隔14天),维持剂量更高(每4个月28毫克)。这项研究在6个月时达到主要终点。6个月时chop-intend量表结果相对于基线的变化表明,高剂量试验组相较匹配假手术对照组取得了具有统计学意义的显著改善(最小二乘均差:26.19;p<0.0001)。
相较已获批的诺西那生钠治疗方案,该在研高剂量治疗方案的初期给药速度更快(两次50毫克,间隔14天),维持剂量更高(每4个月28毫克)。这项研究在6个月时达到主要终点。6个月时chop-intend量表结果相对于基线的变化表明,高剂量试验组相较匹配假手术对照组取得了具有统计学意义的显著改善(最小二乘均差:26.19;p<0.0001)。
在各项次要终点上,高剂量治疗方案相较安慰剂都显示出更优的结果。在关键生物标志物和疗效指标上,高剂量治疗方案也表现出优于已获批的12毫克剂量方案的趋势。高剂量治疗方案的耐受性总体良好,报告的不良事件与sma相关症状及诺西那生钠已知的安全性特征基本一致。与12毫克组(72%,18例)相比,高剂量试验组患者发生严重不良事件的比例更低(60%,30例)。
渤健表示,devote研究的主要结果令人振奋。第64天的数据显示,与已获批的剂量方案相比,高剂量方案显著降低了神经丝水平,表明其能更迅速地减缓神经退行性变。经过持续治疗,存在sma症状的婴儿在高剂量方案下取得显著临床获益。devote研究的详细结果将在后续医学会议上公布。
无独有偶,罗氏旗下基因泰克公司也在几个月前公布了evrysdi关键性firefish研究的最新长期数据。据了解,evrysdi是一种靶向smn2基因的小分子mrna剪接调节剂,通过调节smn2基因mrna的剪接,提高能够表达正常smn蛋白的mrna水平,从而缓解sma患者的症状。evrysdi是全球首款口服、非侵入性小分子sma治疗药物,可以在家中口服或者通过饲管以液体形式给药,可通过系统性递送到中枢神经系统(cns)和外周组织。
这项研究的最新分析显示,到第5年结束时,91%接受evrysdi治疗的1型sma儿童患者存活,81%在没有永久通气的情况下存活,59%儿童能够在没有支撑的情况下维持坐姿至少30秒。到第5年结束时,7名儿童能够站立,3名需要支撑,4名无需帮助,6名可以在支撑下行走。研究表明,如果没有进行治疗,1型sma儿童患者难以达到这样的里程碑,而且通常活不过2岁。
此外,firefish结果还显示,大多数接受evrysdi治疗的儿童也保持了进食和吞咽能力。在第5年接受评估的儿童中,96%能够吞咽,80%能够在没有喂食管的情况下进食。
业内人士表示,随着国产诺西那生钠仿制药报产,渤健高剂量诺西那生钠临床研究取得积极主要结果,以及罗氏口服新药risdiplam取得关键性数据等一系列最新研发进展陆续公布,sma治疗药物将迎来崭新的市场格局。
推荐阅读
吉林敖东“炒股”,荒了医药主业
近年来,上市公司“不务正业”投入巨资炒股致亏的情况屡屡发生,这也导致了云南白药在内的多家公司宣布停止“炒股”。
2023年,中国医药行业仍处于资本下行周期,严峻的形势,对价值创造的可持续性提出挑战,行业发展亟需政策引导。
裁员互撕,2024年,医药人“倒霉让人心疼”
2022年,生物医药行业露了下行的苗头;2023年,裁员潮开始;2024年,下行不但没有结束,还有了愈演愈烈的意思。
挺过2023的寒冬,2024的医疗赛道或将掀开新的篇章。







